PCR引物是聚合酶链式反应(Polymerase Chain Reaction, PCR)中必不可少的组成部分,它们是人工合成的短DNA序列,用于在体外复制特定的DNA片段。引物的设计至关重要,因为它们决定了PCR反应的特异性、效率和成功率。通常,PCR需要一对引物,包括一个上游引物和一个下游引物,分别位于目标DNA序列的两端。引物的长度一般在15-30个碱基对(bp)之间,且应具有适中的GC含量(40%-60%)以确保稳定的双链形成。引物的3'端必须与目标序列完全互补,而5'端则可以进行修饰以添加限制酶位点、荧光标记或其他功能基团。设计引物时,需要考虑引物的熔解温度(Tm),理想情况下应在50-65℃左右,以匹配PCR退火步骤的温度。此外,引物应避免形成二聚体,且不应与非特异序列有高度同源性,以免产生非特异性扩增。在某些应用中,如实时荧光定量PCR(qPCR)和逆转录qPCR(RT-qPCR),引物设计更为严格,要求更高的退火温度和产物大小的限制,以提高定量的准确性。PCR引物的设计可以通过生物信息学软件如Primer Premier或在线工具如NCBI Primer-BLAST来辅助完成,确保引物的特异性、效率和适用性。
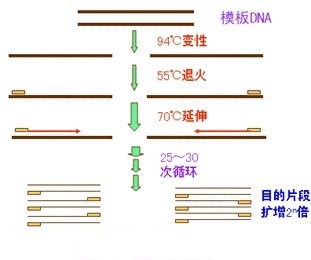
引物浓度在PCR(聚合酶链反应)中非常重要,因为它直接影响到扩增产物的特异性、产量以及实验的成功率。以下是引物浓度对PCR结果的影响:
1. 特异性影响
过高浓度:引物浓度如果过高,可能会导致引物二聚体的形成,即引物之间非特异性结合,从而产生非特异性扩增产物。这会降低目标产物的特异性,影响实验结果的准确性。
过低浓度:虽然低浓度引物可能不会形成二聚体,但过低的浓度可能导致引物与模板结合不足,影响扩增效率,甚至导致无产物或产物量少。
2. 产量影响
适量浓度:引物的适量浓度能够确保在每个PCR循环中,模板DNA能够被充分扩增,产生足够的目标产物。
超量原则:在PCR反应中,引物的浓度通常是超量的,这意味着即使模板DNA的数量变化,扩增产物的数量主要由模板决定,而不是引物。
3. 非特异性扩增
引物二聚体:过量的引物可能会增加非特异结合的机会,形成引物二聚体,这些非特异性产物可能在电泳图谱中与目标条带混淆,需要通过跑胶验证和无模板对照来区分。
模板与引物的平衡:适量的引物浓度可以平衡模板DNA的量,避免引物过量导致的非特异性扩增,特别是在模板DNA浓度低的情况下,增加模板的使用可以减少引物二聚体的形成。
4. 实验条件的调整
退火温度:如果引物特异性不好,适当提高退火温度可以减少非特异性结合。
添加剂:在PCR体系中加入少量甘油或DMSO可以增强特异性,抑制引物二聚体的形成。
5. 引物设计与浓度选择
引物长度与GC含量:理想的引物长度为15~30bp,GC含量在40%~60%,避免长段AT或GC重复序列,以优化引物与模板的结合。
终浓度:通常引物的终浓度在0.1 μM~1.0 μM之间,确保引物过量但不至引起非特异性扩增。对于不同类型的模板DNA,如质粒或基因组DNA,引物浓度的选择可能需要调整。
6. 定量PCR的考虑
随机引物的影响:在反转录过程中使用随机引物会导致cDNA产物的大小不一,影响定量PCR的结果。因此,设计的定量引物对应该靠近mRNA的5’端,以确保cDNA绝对数量的准确性。
7. 循环次数与产物饱和
循环数的调整:过多的循环次数可能导致目标产物饱和,而引物二聚体的扩增会持续进行,因此需要根据实验设计调整循环次数。
总之,引物浓度的合理选择是确保PCR实验成功的关键因素之一,需要综合考虑特异性、产量、非特异性扩增以及实验条件的优化。










