Western blot,即蛋白质免疫印迹技术,是一种广泛应用于分子生物学、生物化学和免疫遗传学中的实验方法,用于检测和分析特定蛋白质的存在、大小、表达水平以及与其他蛋白质的相互作用。
一、原理
Western Blot与Southern印迹杂交或Northern印迹杂交方法类似,但Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素膜NC膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。该技术也广泛应用于检测蛋白水平的表达。
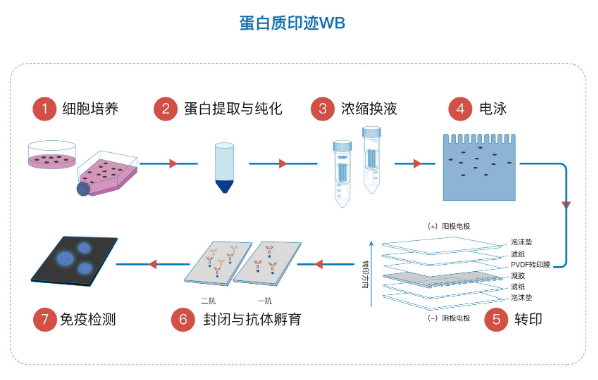
二、分类
Western Blot显色的方法主要有以下几种:
1. 放射自显影
2. 底物化学发光ECL
3. 底物荧光ECF
4. 底物DAB呈色
现常用的有底物化学发光ECL和底物DAB呈色,体同水平和实验条件的是用第一种方法,目前发表文章通常是用底物化学发光ECL。只要买现成的试剂盒就行,操作也比较简单,原理如下(二抗用HRP标记):反应底物为过氧化物+鲁米诺,如遇到HRP,即发光,可使胶片曝光,就可洗出条带。
三、其他
值得一提的是,western blot 这个名称的由来很有意思。最开始做印迹工作的是一个叫做Southern的科学家,但印迹的对象是DNA链,他把这种技术称为Southern blot,后来类似的出现了两个过程相似,但是对象不同的印迹方法,一个针对RNA,一个对蛋白质,人们分别把这两种技术的称为Northern和Western,与这两个技术的发明人没有关系了。
四、western blot的实验步骤:
1. 把聚丙烯酰胺凝胶中的蛋白质电泳转移到硝酸纤维膜上。
1)转移缓冲液洗涤凝胶和硝酸纤维素膜,将硝酸纤维素膜铺在凝胶上,用5ml移液管在凝胶上来回滚动去除所有的气泡。
2)在凝胶/滤膜外再包一张3mm滤纸(预先用转移缓冲液浸湿),将凝胶夹在中间,保持湿润和没有气泡。
3)将此滤纸/凝胶/薄膜滤纸按照厂家建议方法放入电泳装置中,凝胶面向阴极。
4)将上述装置放入缓冲液槽中,并灌满转移缓冲液以淹没凝胶。
5)按照厂家所示接通电源开始电泳转移。
6)转移结束后,取出薄膜和凝胶,弃去凝胶。
2. 将薄膜漂在氨基黑中快速染色,直至分子量标准显现时取出,记录下标准位置。
3. 用100ml水洗涤纤维素膜,必要时可用脱色缓冲液。
4. 膜置印迹缓冲液中于37℃保温1小时。
5. 室温下,用PBS-Tween缓冲液洗涤薄膜。
6. 用封口机将薄膜封入塑料袋中,尽可能不留空气。
7.袋的一角剪一缓冲液的小口,用透析袋夹紧。
8.混合:NGS(100微升),印迹缓冲液中的抗体(10毫升),加在装薄膜的袋中,于室温下摇动2小时(或4℃过夜)
9.用总体积300ml PBS-Tween缓冲液,分4次在一浅盘中洗涤薄膜,每次75ml。
10. 将连接生物素的羊抗兔IgG(40微升溶于10毫升印迹缓冲液/100微升 NGS)加在袋内,于室温下摇动1小时。
11.按步骤9洗涤。
12.加入抗生素蛋白-HRP(40微升溶于10毫升印迹缓冲液/100微升 NGS),于室温下摇动。
五、注意事项:
western blot中转移在膜上的蛋白处于变性状态,空间结构改变,因此那些识别空间表位的抗体不能用于western blot检测。这种情况可以将表达目的蛋白的细胞或细胞裂解液中的所有蛋白先生物素化,再用酶标记亲和素进行western blot。实验中取胶和膜需带手套。










