PCR (polymerase chain reaction)聚合酶链式反应,又称体外DNA扩增技术可以将微量目的DNA片段扩增一百万倍以上。PCR的原理在DNA聚合酶催化下,以母链DNA为模板,以特定引物为延伸起点,通过变性、退火、延伸等步骤,体外复制出与母链模板DNA互补的子链DNA的过程。
PCR引物设计的基本原则包括:
1. 引物长度:
1) 通常在1530个碱基对(bp)之间,理想长度为1827bp。
2) 过长的引物可能导致延伸温度过高,不适合Taq DNA聚合酶的反应条件。
2. GC含量:
1) 40%60%之间,以4555%为佳,确保复性条件最佳。
2) 上下游引物的GC含量和Tm值应接近。
3. Tm值:
1) 引物的Tm值应在5580℃之间,理想为72℃左右,以保证复性效率。
2) 正向和反向引物的Tm值相差不超过5℃。
4. 3'端特性:
1) 3'端碱基一般不使用A,因为A可能增加错误引发的机率。
2) 3'端避免出现3个以上的连续碱基(如GGG或CCC)。
3) 3'端的ΔG值应较低,绝对值不超过9,以减少错配引发。
5. 引物结构:
1) 避免引物内部或两引物之间的互补,尤其是3'端的互补。
2) 3'端不应形成发夹结构或二聚体,这些结构可能干扰引物与模板的结合。
3) 引物的ΔG值最好呈正弦曲线,3'端较低,中间和5'端相对较高。
6. 特异性:
1) 引物不应与非特异扩增序列有超过70%的同源性,且避免连续8个碱基的互补。
2) 引物应在核酸保守区内设计,并确保引物与模板的特异性。
7. 5'端修饰:
5'端可以修饰以引入限制酶位点、突变位点、标记物等。
8. 碱基分布:
1) 引物序列中碱基分布应随机,避免聚嘌呤或聚嘧啶的存在。
2) 引物自身不应有连续4个碱基的互补,以免形成发夹结构。
9. 产物大小:
特别对于实时荧光定量PCR(qPCR),产物大小通常限制在80250bp之间。
10. 其他注意事项:
1) 避免3'端与模板的多个位点互补,防止非特异性扩增。
2) 在设计引物时,应考虑引物二聚体的形成,并尽量避免。
3) 对于RTqPCR,引物应设计在编码区外显子上,避免内含子。
遵循这些原则,可以提高PCR反应的效率和特异性,确保实验的成功。
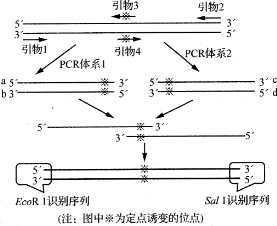
设计引物所要考虑注意事项:
1.酶切位点
两个酶切位点应是载体上的,所连接片断上没有这两个位点,且距离不能太近,否则往往导致两个酶都切不好。因此,两个酶切位点要紧挨在一起,只能切一个,除非恰好是与上面两个酶在一起的酶切位点,最好隔四个核苷酸。且不能有碱基的交叉,比如AGATCTTAAG,这样的位点比较难切。
2.酶的选择
最好使用双酶切效率高的,但两个酶切点最好不要是同尾酶(切下来的残基不要互补),否则效果相当于单酶切,最好使用具有共同buffer,且较常用的酶(如hind3,bamh1,ecor1等),这样可以省钱。
3.Tm的计算
Tm是由互补的DNA区域决定的,而不互补的区域对DNA的溶解是没有作用的。因此,对于引物的Tm,只有和模板互补的区域对Tm才有贡献。计算Tm时,只计算互补的区域(除非你的酶切位点也与模板互补)。设计引物的时候,先不管5'端的修饰序列,把互补区的Tm控制在55度以上(我喜欢控制在58以上,具体根据PCR的具体情况,对于困难的PCR,需要适当提高Tm),再加上酶切位点和保护碱基,这样的引物通常都是可用的,即使有小的问题,也可以挽回。
Tm温度高的引物就比较容易克服3’发卡、二聚体及3'非特异结合等问题。简单的计算公式可以用2+4的公式。若你计算的Tm值达到了快90 ,不包括酶切位点。引物公司给你发的单子是包括酶切位点的。自己可以再估计一下。如你设计了带酶切位点的引物,总长分别为29、33个碱基,去掉酶切位点和保护碱基,分别为17、21个碱基。引物公司给的单子是70多度,实际用的只有50度,用55度扩的结果也差不多。
其它关于Tm值的计算,有用PP5.0进行评价的,需要考虑base number、GC%、Tm、hairpin、dimer、false priming、cross dimer等参数。
4.退火温度
退一般退火温度为Tm-5度,退火温度的计算可以不把加入的酶切位点及保护碱基考虑进去, PCR几个循环后,引物外侧的序列已经参入了扩增片断中,所以你可以在预变性后多加几步,温度比你Tm值低些(这样可能会增加非特异性),Tm值是你包括酶切位点及保护碱基的Primer计算出来的。
5.5’端保护碱基
一般在5'端加保护碱基,如果你扩增后把目的条带做胶回收转入T-VECTOR或者其它的载体的话,酶切时可以不需加保护碱基
6.引物二聚体
关于引物二聚体,最好用primer或是其他设计引物的软件进行计算一下,看看引物之间的△G(自由能)的绝对值,如果小于10,一般是问题的。如果稍大,PCR时可以提高一下退火温度,一般是没有问题的。如果3’端形成二聚体,并且自由能绝对值较大,如果 PCR没有条带,建议重新设计引物。此外,所加的三个核苷酸的保护序列经过尽心设计有时也可以降低二聚体的△G。
7.引物的设计
在设计酶切位点时,最好能尽可能多的利用引物本身的碱基。这是因为,一个特异性引物一般都是20bp左右,再加上酶切位点序列和保护性碱基,大致就是28bp左右了。而我们在设计退火温度时,与引物的长度有关,比正常的引物(20bp) 的Tm肯定要高一些。如果我们能利用引物自身的部分序列,就可以有效地减少引物的长度。
还有,有些酶是离不开末端序列的,因此,在设计一个酶位点时,最好把该酶的性质弄清楚。设计时限制性酶切位点是应该在5’端的顶端。在设计引物时,常在5’端添加酶切位点,以利于PCR产物连接到载体。
设计引物时保证在最后5个核苷中含有3个A或T。先用软件设计出合适的引物,引物的3’端是引发延伸的起点,因此一定要与模板准确配对,应尽量避免在引物3’端的第一位碱基是A(容易错配)。引物3’端最佳碱基的选择是G和C,因为他们形成的碱基配对比较稳定,目的序列上并不存在的。










